Viedoc Clinic / PMS
Viedocは、驚くほど直感的なシステムで、臨床試験を効率的に管理します。皆様は専門分野に集中していただき、記録はViedocにお任せください。
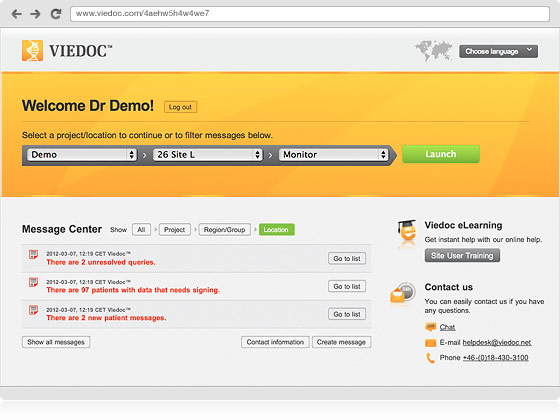
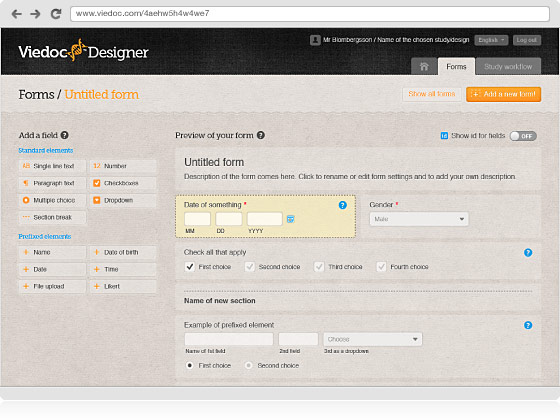
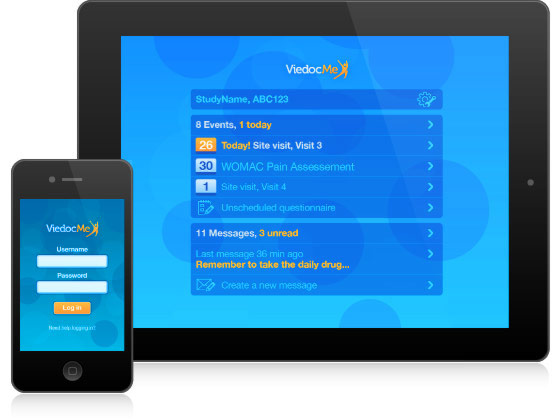
Viedoc Clinicは、治験実施施設にて行われた、すべての活動の管理および報告を目的として、医師や治験コーディネーターとして働く皆様をサポートするために開発されたものです。プロジェクト・マネージャー、モニター、データ・マネージャー、統計解析者、または、コーダーの皆様でしたら、データの閲覧および概括評価のためにViedocへのアクセスが便利です。2004年以来、Viedocは全世界の治験実施施設にて、300件以上のプロジェクトにてご利用をいただいてまいりました。直感的なインターフェースは多言語をサポートし、構築トレーニングに要する時間が短期間であることも、Viedoc Clinicは多忙な治験現場の皆様のお役に立てる所以です。
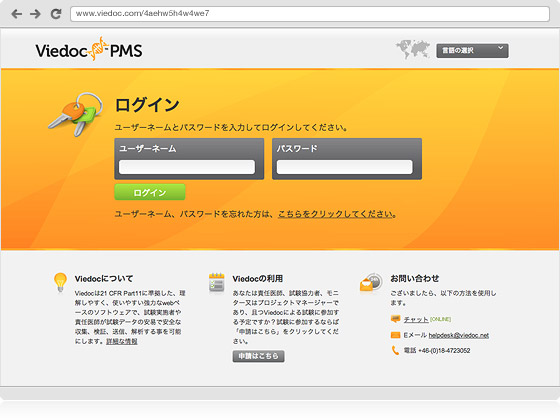
ViedocPMSは、日本の製造販売後調査特有の規制要件やガイドラインをサポートしております。調査における医師の主な役割としての安全性と有効性の報告機能を取り入れました。ViedocPMSは、信頼と実績のある弊社のEDC製品のプラットフォーム上に構築し、支払いや契約、症例の進捗状況管理など製造販売後調査に必要な機能を追加したものです。
Viedoc Clinicの体験を希望される方は、デモ版へのアクセスを設定しますので、ご連絡ください。また、お見積り予定れている試験の概要をご連絡いただければ、お見積りをお送りします。是非、Viedocにお任せください。皆様が望んでいることをViedocが上手にこなしてくれることに驚きを覚えるはずです。そして、Viedocが想像以上に頼りになることを実感いただけると思います。